清华新闻网11月6日电 基因的遗传通常遵循孟德尔分离定律,即等位基因在有性生殖过程中以相同的概率传递给后代。然而,基因组中存在一些特殊基因,它们能够打破这一规则,以更高的频率遗传给下一代。这种现象被称为减数分裂驱动(meiotic drive)。造成这一现象的一类自私遗传因子通过选择性地杀伤不携带自身的配子,从而确保自己能够优先遗传给后代。由于这种独特的作用机制,它们被称为杀手减数分裂驱动因子(killer meiotic driver)。这类因子在真核生物中普遍存在,是导致杂交不亲和的关键因素,并被认为是物种形成的重要推动力。尽管如此,我们对杀手减数分裂驱动因子在基因层面的认识仍然非常有限,对其分子机制的了解更是不足。
11月1日,bat365在线平台生物医学交叉研究院杜立林实验室与中国科学院生物物理研究所叶克穷实验室合作,在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)在线发表两篇研究论文,揭示了一种新的杀手减数分裂驱动因子的分子机制。在第一篇题为“一个减数分裂驱动程序劫持了一个表观遗传阅读器来破坏非载体后代的有丝分裂”(A meiotic driver hijacks an epigenetic reader to disrupt mitosis in noncarrier offspring)的论文中,研究人员发现,在裂殖酵母中,一个此前被认为是细胞生长所必需的基因实际上是一种杀手减数分裂驱动因子。研究揭示,该基因通过其毒性产物“劫持”细胞中的组蛋白结合蛋白来破坏有丝分裂,从而杀伤不携带该基因的后代。在第二篇题为“结构二元性使单一蛋白质能够作为减数分裂驱动的毒素解毒剂对”(Structural duality enables a single protein to act as a toxin–antidote pair for meiotic drive)的论文中,研究人员进一步揭示了该杀手基因的选择性杀伤机制:它能利用同一蛋白产物的两种不同构象,形成一个"毒药-解药"系统。在这一系统中,虽然毒药会影响所有配子,但只有携带该基因的配子能够产生解药来中和毒性,从而实现对不携带该基因的配子的选择性杀伤。
裂殖酵母通常以单倍体形式进行无性生长,但在营养缺乏时会进行有性生殖。单倍体细胞交配形成二倍体,随后通过减数分裂产生四个单倍体孢子。这些孢子在营养充足的环境中会重新开始无性生长。研究人员发现一个被认为是“必需基因”的裂殖酵母基因在单倍体中敲除后并不影响细胞生长,在二倍体中纯合敲除的情况下,后代也正常存活。然而,在二倍体中杂合敲除时,不携带该基因的后代无法存活(图1)。因此,研究人员判断这个基因并非细胞生存所必需,而是一个杀手减数分裂驱动因子,并将其命名为tdk1(transmission-distorting killer)。
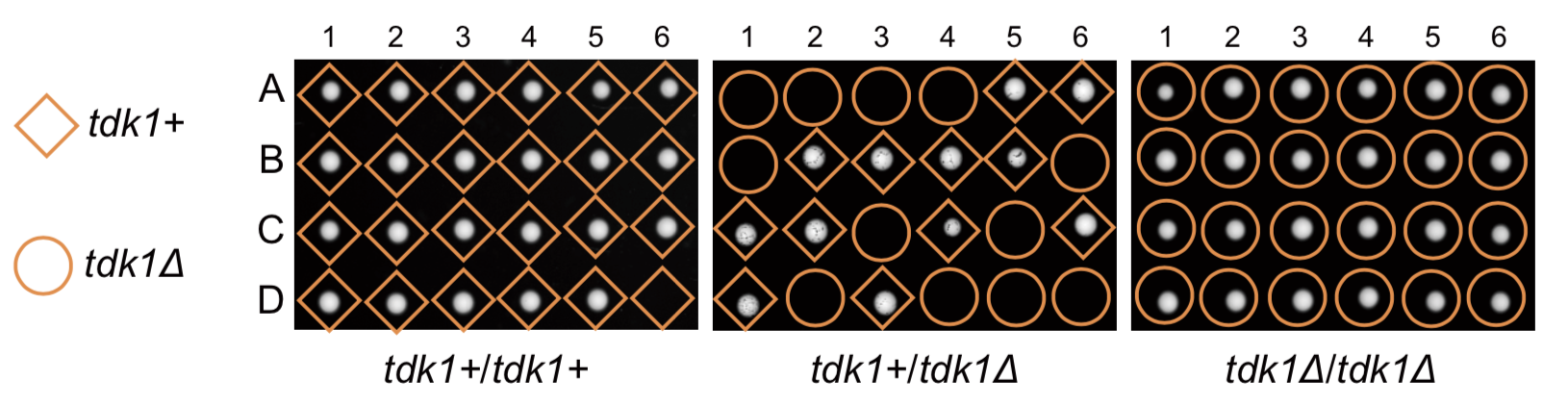
图1.tdk1基因是一个杀手减数分裂驱动因子
在真菌中,已知的杀手减数分裂驱动因子通常在孢子阶段表现出杀伤行为,因此被称为“孢子杀手”。然而,tdk1展现出一种新的杀伤模式。活细胞成像显示,tdk1不在孢子阶段杀伤,而是在孢子萌发后的第一次有丝分裂中显现其杀伤效果,阻碍染色体的正常分离(图2)。
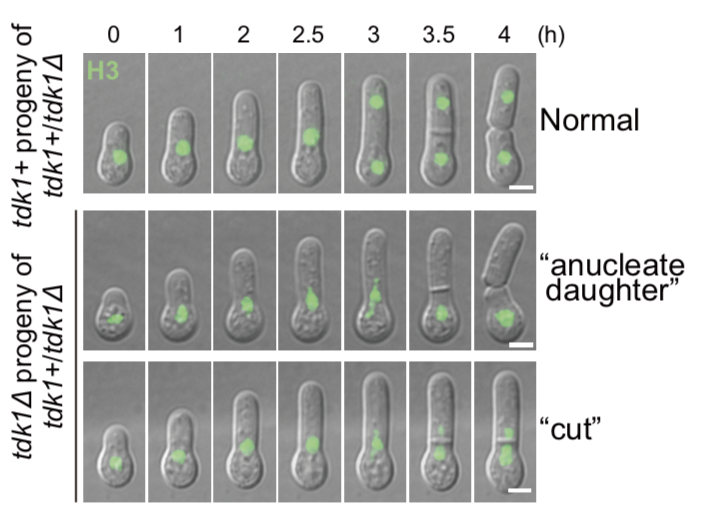
图2.tdk1在杂合敲除二倍体后代中导致不携带自身的细胞染色体分离异常
对裂殖酵母天然菌株中的tdk1基因的分析发现了一种失去杀伤能力的HT3变体,它带有六个氨基酸变异。通过有性生殖阶段的邻近标记实验,研究人员发现乙酰化组蛋白结合蛋白Bdf1能与野生型Tdk1蛋白相互作用,却不与HT3变体结合。进一步研究表明,结合Bdf1对tdk1的杀伤能力至关重要。利用冷冻电镜技术,研究人员观察到Tdk1的羧基端区域形成三聚体,然后继续二聚化形成六聚体,并与Bdf1相互作用(图3左)。而HT3变体在与Bdf1结合的关键区域发生了点突变,导致其丧失了杀伤能力。
有趣的是,研究人员发现,Tdk1在孢子中会形成包含数千个分子的超分子聚合体,并与Bdf1相互作用。但在无性生长阶段,Tdk1不形成超分子聚合体,也不与Bdf1结合,对细胞没有毒性。进一步分析揭示,在无性生长阶段,Tdk1以四聚体形式存在(图3右),这种形式无法与Bdf1发生相互作用。
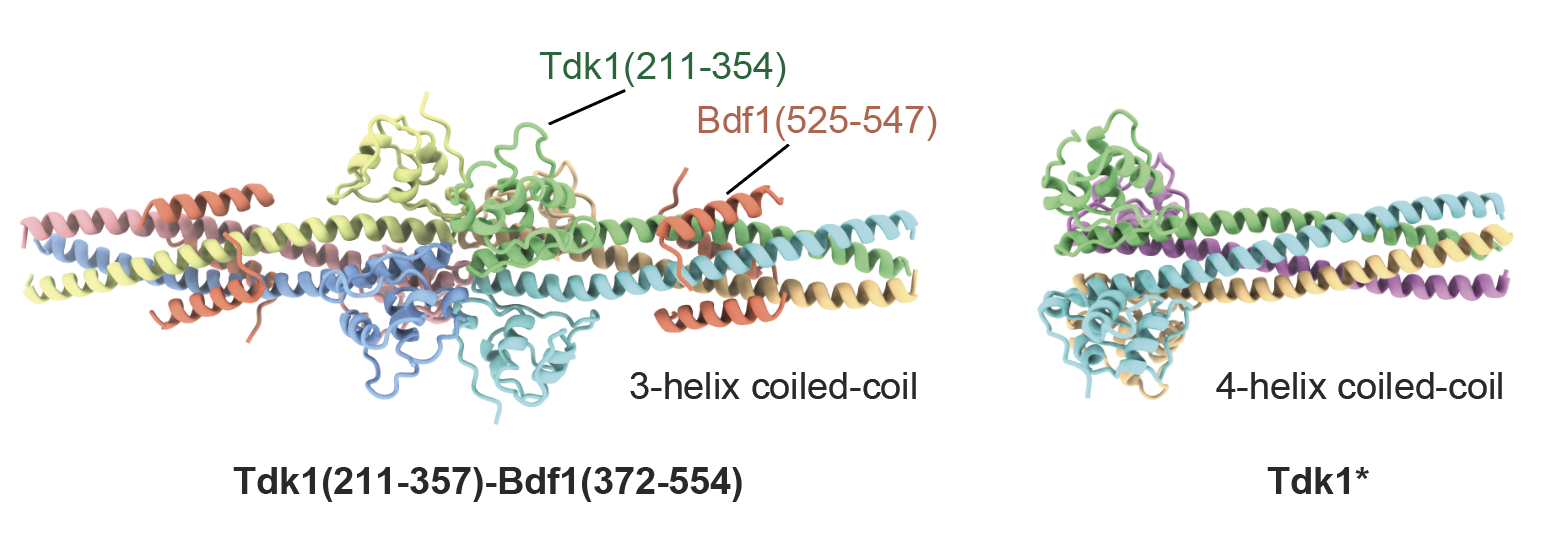
图3.Tdk1蛋白有两种不同构象
研究人员还揭示了Tdk1利用Bdf1发挥杀伤作用的过程。Tdk1超分子聚合体利用Bdf1的组蛋白结合能力导致染色体异常粘连,从而阻碍染色体分离。在不携带tdk1基因的后代中,这种超分子聚合体持续存在,并在孢子萌发后的有丝分裂过程中阻碍染色体分离,导致细胞死亡(图4)。而在携带tdk1基因的后代中,新合成的Tdk1不仅无毒,还能拆解在孢子中形成的Tdk1超分子聚合体,确保染色体正常分离。
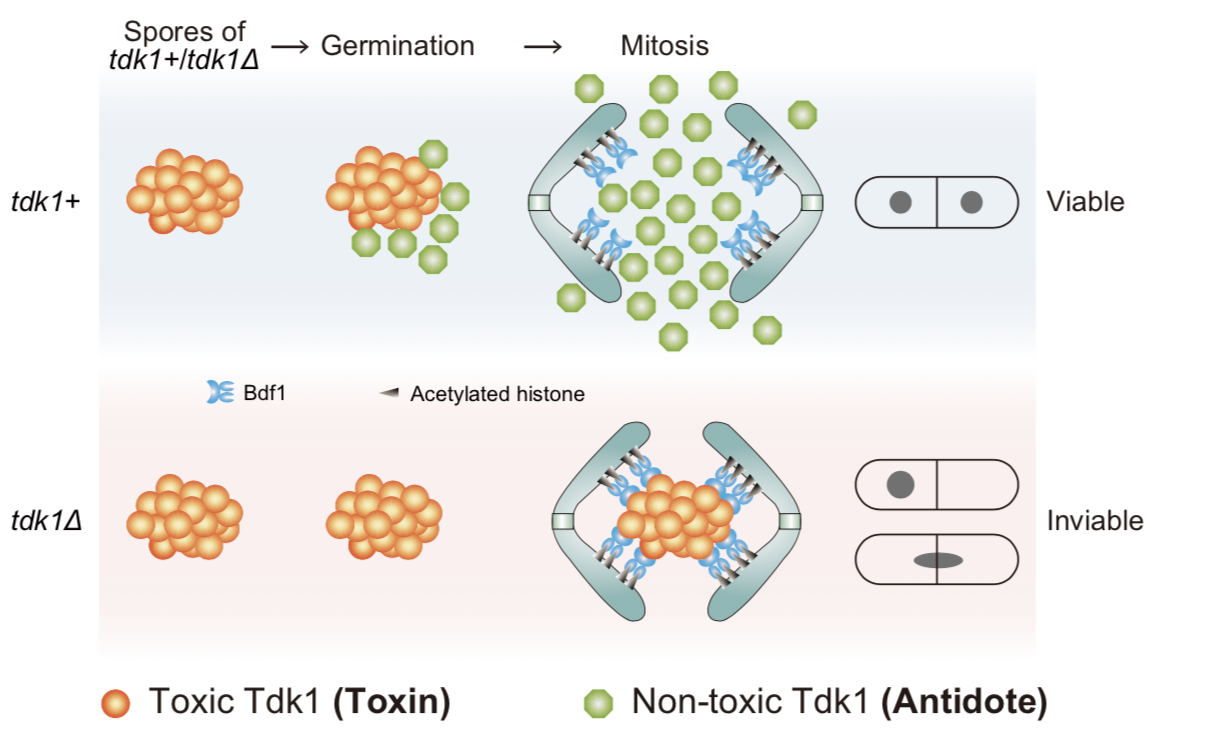
图4.tdk1选择性杀伤的“毒药–解药”模型
综上所述,曾被误认为是“必需基因”的tdk1基因,实际上是一种杀手减数分裂驱动因子。该基因通过所编码蛋白的两种不同构象,构建了一个“毒药–解药”系统。在tdk1+/tdk1Δ杂合二倍体减数分裂时,所有后代孢子中都产生了Tdk1的毒性构象。在不携带tdk1基因的后代中,Tdk1毒性构象持续存在,并通过劫持组蛋白结合蛋白破坏孢子萌发后的有丝分裂,从而造成杀伤;而在携带tdk1基因的后代中,新合成的Tdk1作为“解药”中和先前形成的Tdk1“毒药”,保护细胞免受杀伤(图4)。这些研究成果不仅发现了一种新的杀手减数分裂驱动因子,还阐明了其独特的杀伤机制,首次揭示单一蛋白能通过可变蛋白结构组成“毒药–解药”系统。这些发现对深入理解减数分裂驱动现象具有重要意义。
杜立林实验室的华余博士、叶克穷实验室的张建秀博士以及杜立林实验室的2019级博士生杨曼芸和张凡一(第一篇)为共同第一作者;杜立林研究员、叶克穷研究员和华余博士共同担任两篇论文的通讯作者。其他作者包括杜立林实验室的任静怡、吕晓晖、丁彦、索芳、邵光灿、李俊,叶克穷实验室的梁凌飞,以及bat365在线平台生物医学交叉研究院董梦秋研究员。研究得到国家自然科学基金委、中国科学院、国家重点研发计划、北京生命科学研究所和bat365在线平台生物医学交叉研究院资助,在北京生命科学研究所与中科院生物物理研究所完成。
论文链接:
https://doi.org/10.1073/pnas.2408347121
https://doi.org/10.1073/pnas.2408618121
供稿:生物医学交叉研究院
题图设计:李柳依
编辑:李华山
审核:郭玲